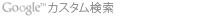特定臨床研究の該当性判断フロー
| NO. | チェック項目 | 該当の有無 |
|---|---|---|
| 1 | 「薬機法に基づいて実施する研究(治験等)」または「再生医療等安全確保法」に基づいて実施する研究である
|
□ はい → 「判定A」 □ いいえ → No.2へ |
| 2 | いわゆる「観察研究」である
|
□ はい → 「判定B」 □ いいえ → No.3へ |
| 3 | 医薬品等を人に対して用いる研究である。
|
□ はい → No.4へ □ いいえ → 「判定B」 |
| 4 | 医薬品等の有効性・安全性を調査する目的の研究である
|
□ はい → No.5 □ いいえ → 「判定B」 |
| 5 | 研究に用いる医薬品等の製造販売業者(製薬企業等)からの資金提供を受けている
|
□ はい → No.6-1 □ いいえ → No.6-2 |
| 6-1 | 研究に用いる医薬品等が未承認・適応外使用である
|
□ はい → 「判定C」 □ いいえ → 「判定D」 |
| 6-2 | □ はい → 「判定E」 □ いいえ → 「判定F」 |
注*1)
- 添付文書の効能・効果に記されていない疾患は承認範囲外(適応外使用)となる。
- 日常診療の中で患者の状態に応じて医師の裁量のもと、適宜増減又は減量がなされる場合には承認範囲外ではないが、研究計画書で、承認されている用法・用量とは異なる投与量、投与間隔などを一律に規定している場合は承認範囲外となる。
- 「用法等」と異なる用法等で用いられた場合、保険診療として取り扱われたとしても承認範囲外となる。